![]()
Aunque hay muchas reacciones diferentes todas tienen algunas cosas en común:
Normalmente los productos suelen presentar un aspecto diferente del que tenían los reactivos.
Algunas reacciones desprenden energía, las llamamos exotérmicas; otras, en cambio,
necesitan energía para que se realicen y las llamamos endotérmicas.
- Ejemplos de reacciones exotérmicas:
Al acercar una cerilla a la cocina de butano para calentar la comida, aparte de gastarse el gas,
se forman gases (agua y dióxido de carbono) y por supuesto energía, por lo que esta
reacción es exotérmica:

Imagen en Pixabay bajo licencia CC
Butano (C4H10) + oxígeno (O2) → dióxido de carbono (CO2) + agua (H2O) + calor (energía)
También son exotérmicas las reacciones del agua con Óxido de Calcio (Cal viva,
que se preparaba antiguamente para "encalar" las paredes de la casa o desinfectar los algibes) o con sodio.
Otro ejemplo exotérmico se produce cuando nuestro organismo realiza la combustión
de los alimentos ingeridos. Gracias a esa energía que se genera podemos vivir.
- Ejemplos de reacciones endotérmicas:
Un ejemplo de reacción endotérmica es la producción del ozono (O3). Esta reacción ocurre en las capas altas de la atmósfera, donde las radiaciones ultravioleta suministran la energía suficiente para romper la molécula de O2 en 2 átomos libres de oxígeno que se unirán a otra molécula de oxígeno y se formará una de ozono. También ocurre cerca de descargas eléctricas (cuando se producen tormentas eléctricas).
Molécula de oxígeno (O2) + energía del sol → Átomos de oxígeno libres (O)
Molécula de oxígeno (O2) + Átomos de oxígeno libres (O) → Ozono (O3)
![]()
Importante
La característica más importante de las reacciones químicas es que la suma de las masas de
los reactivos es igual a la suma de las masas de los productos. Esto se conoce
como "La ley de conservación de la masa de Lavoisier"
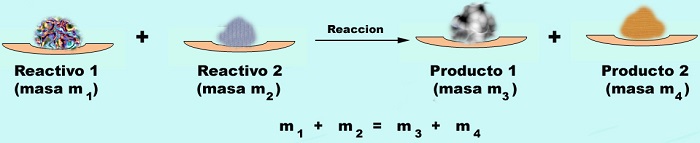
| Elaboración propia |
¿Cómo tiene lugar una reacción química?
Se separan los átomos de los reactivos y se combinan de otra forma dando lugar a
los productos.
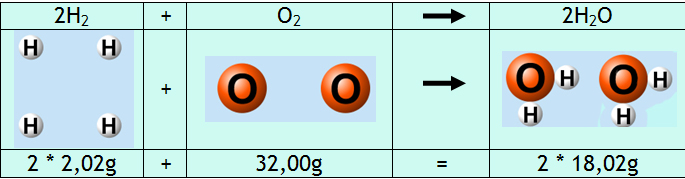 |
| Elaboración propia |
Es importante que tengas en cuenta que el número total de átomos de cada elemento en los reactivos tiene que ser igual al número total de átomos de cada elemento en los productos. Conseguir que esto sea así es lo que se llama ajustar una reacción química.
Mira cómo sería, una vez ajustada, la reacción de combustión del butano:
2 C4H10 + 13 (O2) → 8 (CO2) + 10 (H2O) + calor (energía)
Comentarios
Publicar un comentario