¿Cómo se unen los átomos?
 |  |  | |
Imágenes en Pixabay de Peggy_Marco 1, 2 , 3 . Dominio público | |||
Cuando las personas nos queremos unir, normalmente lo hacemos a través de nuestras manos.
Pero los átomos no tienen manos. ¿Cómo se unen, entonces, para formar las moléculas?
Pues a través de sus electrones, mediante uniones que se denominan enlaces, y que pueden
ser de distintos tipos. ¿Quieres conocer los más comunes?
Recuerda dos cosas que ya has estudiado:
- Los electrones tienen carga negativa y los protones positiva.
- Los átomos tienen el mismo número de electrones en su corteza que de protones en su núcleo.
Y ahora, dos nuevas:
- Si un átomo pierde uno o más electrones, se quedará con más protones que electrones y,
- por tanto, con más carga positiva que negativa. Ya no es un átomo, sino un ión positivo (catión).
- Si un átomo gana uno o más electrones, tendrá más electrones que protones y, por tanto,
- con más carga negativa que positiva. Tampoco será ya un átomo, sino un ión negativo (anión).
Importante
Un ión es un átomo con carga, negativa o positiva
Iónico y covalente son los tipos más importantes de enlaces entre átomos.
Observa lo que sucede en las animaciones:
| ENLACE IÓNICO | ENLACE COVALENTE |
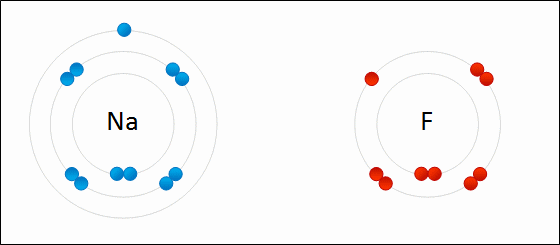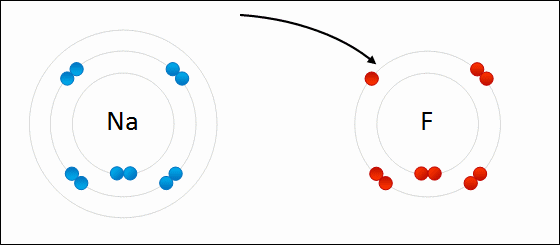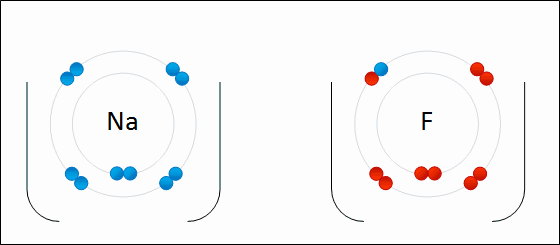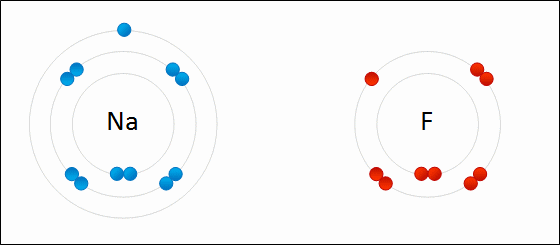 | 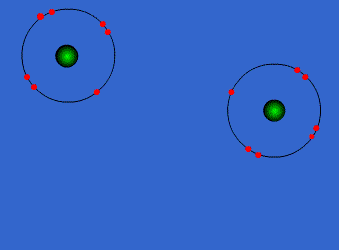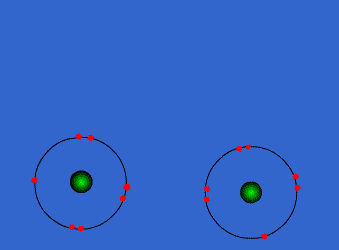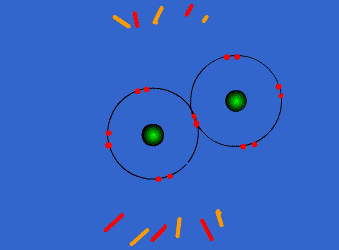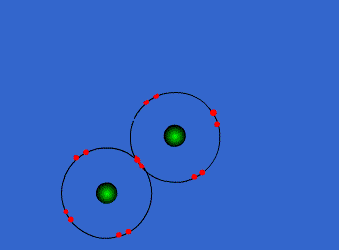 |
Un átomo pierde electrones y el otro los gana. Se forman iones de signo opuesto, que se atraen | Los átomos comparten sus electrones. No se forman iones |
| Animacion en Wikimedia commons deWdcf. Licencia cc | Animación Giphy destaff.aub.edu.lb. Licencia aub |
.
Para saber más
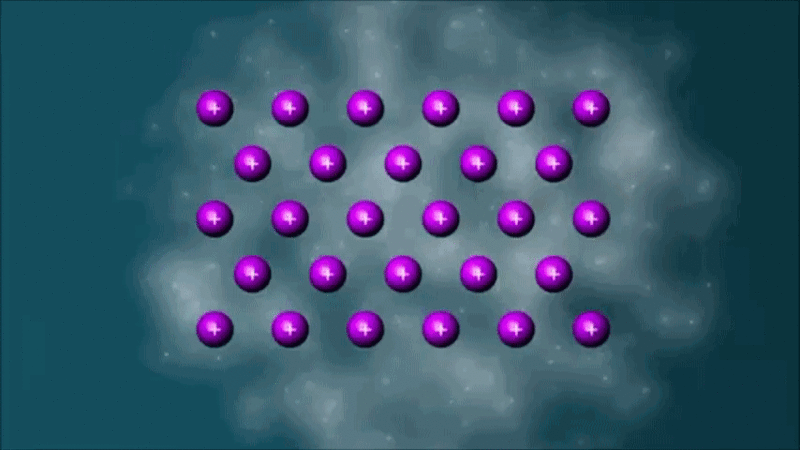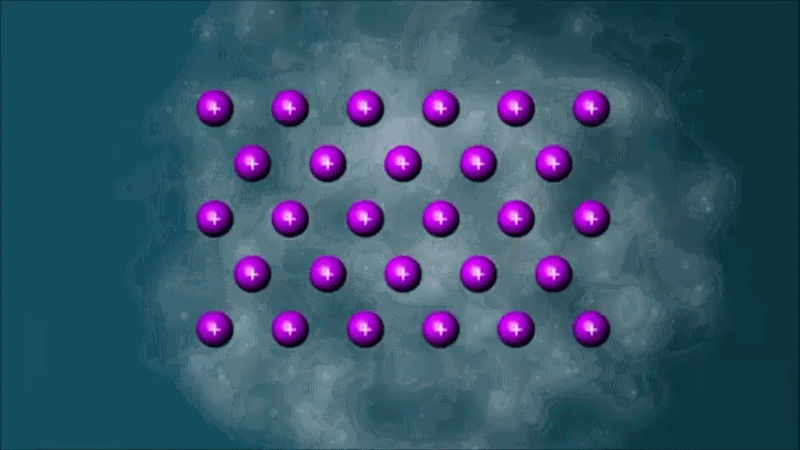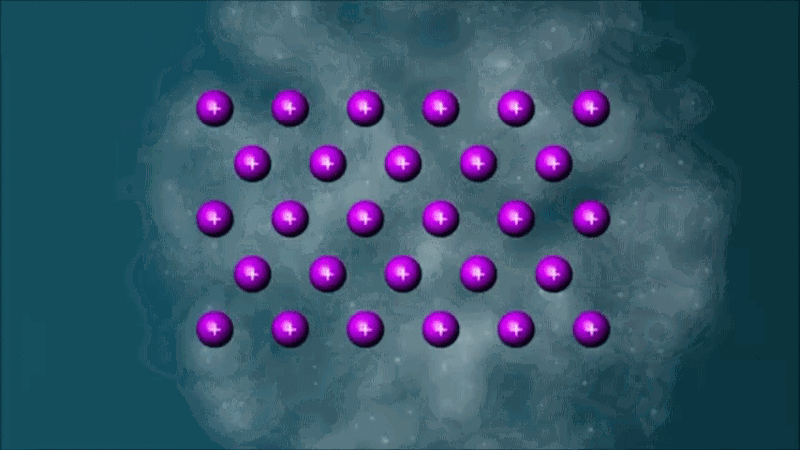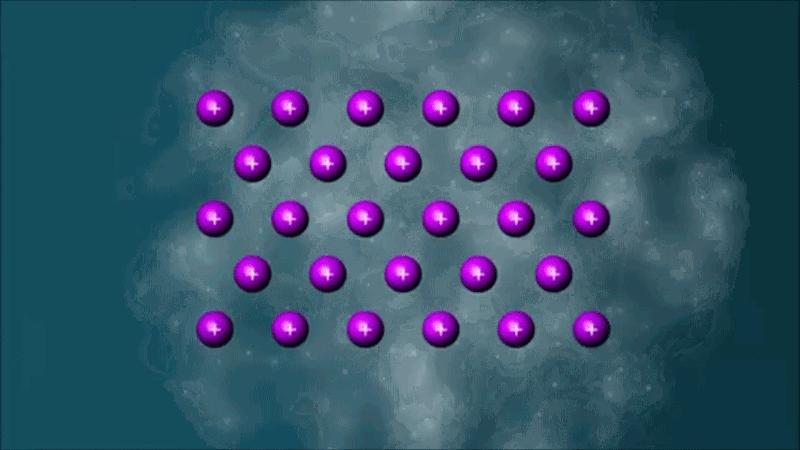
Enlace metálico
Animación en Wikimedia commons de ClassroomVideo. Con autorización del propietario |
Los metales presentan un tipo de enlace característico y propio, denominado enlace metálico.
En este vídeo de Robert Esquivel te explican qué características tiene.
Pregunta Verdadero-Falso
1. Indica si las siguientes afirmaciones son verdaderas o falsas
Pregunta Verdadero-Falso
2. Indica si las siguientes afirmaciones son verdaderas o falsas:
Comentarios
Publicar un comentario