Estás desayunando un bizcocho, y al partirlo se te ha desmigajado. ¿Serán esas pequeñas migas la estructura básica de la materia?
Hace ya mucho que se sabe que no, que incluso la miga más pequeña aún puede dividirse en otras más pequeñas, y éstas en otras aún menores...
Esto lleva a pensar que en algún momento tras muchas divisiones, se llegaría a la “miga que no se puede dividir”, el componente básico del bizcocho… los átomos.
Pero… ¿qué es un átomo?
Los átomos son los componentes básicos de la materia. Un átomo está constituido por:
- La corteza donde se encuentran los electrones (con carga eléctrica negativa).
- El núcleo que es la parte central del átomo, formado por los protones (con carga eléctrica positiva) y neutrones (sin carga).
En el núcleo se concentra aproximadamente el 99.99% de la masa total del átomo y tiene carga positiva.
Curiosidad
 |
Elaboración propia a partir imágenes en pixabay de Pixaline y PublicDomainPictures. Dominio público |
Los dibujos engañan
Cuando se ven dibujos de un átomo, parece que protones, neutrones y electrones son del mismo tamaño, y que el núcleo es bastante grande. ¿No es así?
Los átomos son muy pequeños, mucho, tanto que no se ven ni con el más potente de los microscopios. Pero a pesar de ello los científicos tienen medios para averiguar lo grandes que son, para medirlos.
Esas medidas les llevan a la sorprendente conclusión de que el espacio que ocupa el núcleo es enormemente reducido respecto al del átomo.
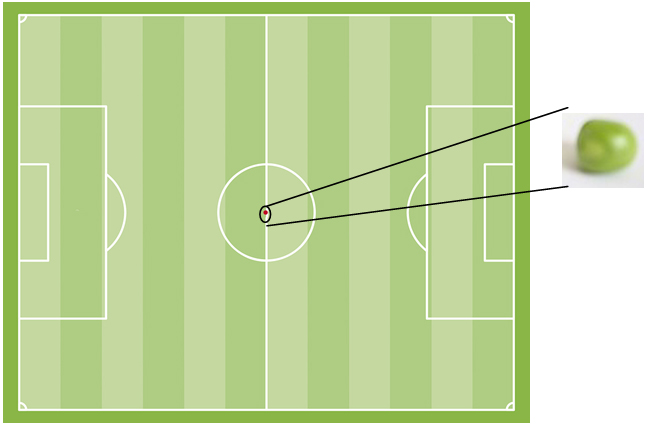
Tanto, que si el núcleo tuviese el tamaño de un guisante y lo situásemos en el centro de un campo de fútbol, el átomo sería una esfera (casi hueca) cuyos límites pasarían por las porterías del campo. Los electrones serían como mosquitos volando por el campo.
Para ser exactos, el volumen del átomo es unas 1015 veces mayor que el núcleo
volumen d![]()
Importante
Un poco de Historia
 |
| Imagen en Wikimedia commons de Kurzon. Dominio público |
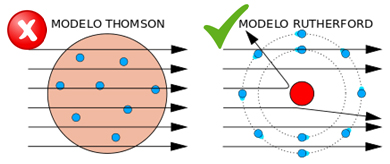
Si tenemos en cuenta que la idea del átomo aparece en Grecia en el siglo
V a.c., es normal que, hasta llegar al modelo actual de estructura atómica, se hayan ido sucediendo diversas teorías, que siempre eran posteriormente descartadas debido a nuevas experiencias y descubrimientos sobre la naturaleza del átomo.
La base del modelo actual se debe a Bohr, aunque posteriormente ha sido mejorado por Sommerfeld y Schrödinger, entre otros.
Pregunta de Elección Múltiple
Pregunta Verdadero-Falso
3. Indica si las siguientes afirmaciones, referidas al átomo, son ciertas o no.
Comentarios
Publicar un comentario